Выступление доктора MD Ли Чэён, заведующего отделением интегративной онкологии в больнице GSAM, Южной Кореи.
Моя специальность – онкологическая хирургия, в том числе лапароскопическая хирургия. Основная тема сегодня – лечение канцероматоза брюшины при раке желудка, кишечника, яичников, злокачественной мезотелиомы и клиническая оценка результатов применения лапароскопической гипертермической интраперитонеальной химиотерапии (LHIPEC).
Патофизиология и методы лечения канцероматоза
Под перитонеальным канцероматозом понимают не удаленные метастазы в других органах, а локально-региональные метастазы.
Существует 2 основных пути возникновения канцероматоза брюшины:
- транссерозный рост опухоли. Прорастание и проникновение опухолевых клеток через слой стенки органа;
- распространение опухолевых клеток во время операции. Раковые клетки могут попасть в брюшину при рассечение кровеносных и лимфатических сосудов или других манипуляций хирурга.
Перитонеальная диссеминация происходит с помощью двух разных процессов:
- А – трансмезотелиальный процесс;
- В – транслимфотический процесс.
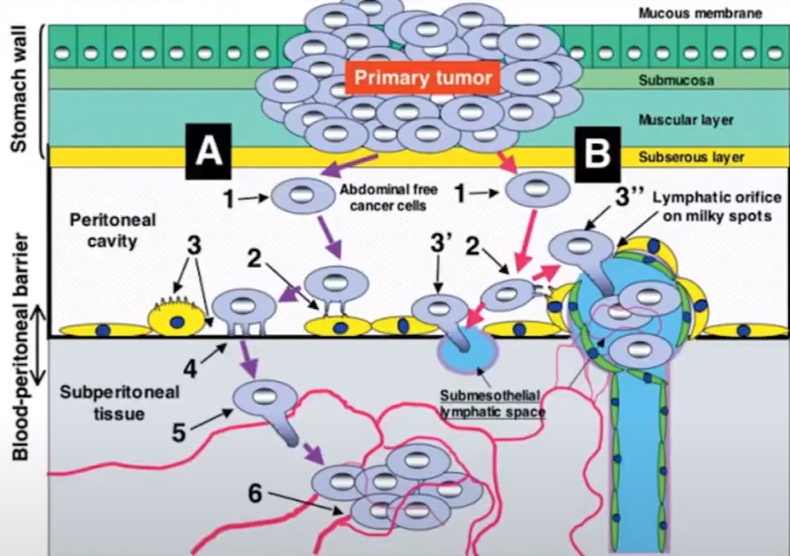
Перитонеально-плазменный барьер является важным фармакологическим элементом при планировании лечения пациентов с перитонеальными метастазами.
Этот физиологический барьер:
- он ограничивает всасывание лекарственных препаратов из полости брюшины в кровь;
- противоопухолевые препараты, используемые системно, с помощью капельницы, плохо проникают в раковые клетки брюшины.
Поэтому необходимо совмещать их с внутрибрюшной химиотерапией.
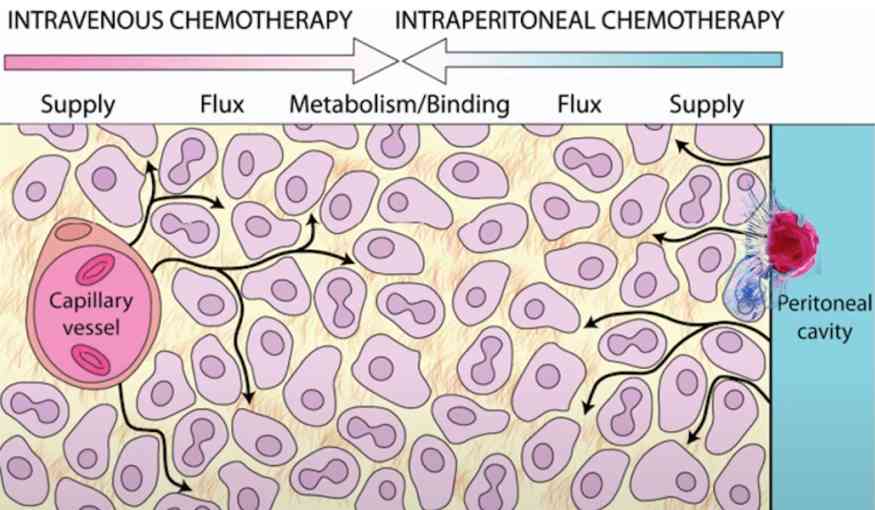
Существуют различные способы доставки противоопухолевых агентов в брюшину:
- HIPEC – проводится, как правило, после циторедуктивной операции. Во время операции, по максимуму удаляются пораженные раковыми клетками ткани, после чего производится перфузия гипертермической жидкости и химиотерапевтического агента в брюшную полость;
- LHIPEC – это процедура HIPEC, проводимая лапароскопически. Это основной метод применяемый мной в течении последних лет;
- PIPAC – это метод распыления в брюшной полости аэрозольной химиотерапии под давлением;
- NIPEC – интраперитонеальная химиотерапия комнатной температуры.
Стандартным методом лечения перитонеальных метастазов считается системная химиотерапия, но в настоящее время все более широко стали применять интраперитонеальную химиотерапию. Ее главное преимущество по сравнению с системной внутривенной химиотерапии — это возможность применения более высоких доз противоопухолевых препаратов. Высокие дозы химиопрепаратов воздействуют на внешнюю оболочку опухоли при внутрибрюшинном введении препарата.
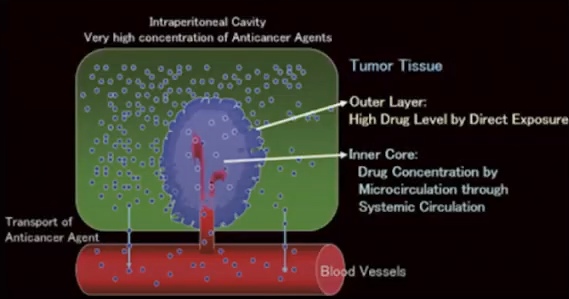
Интраперитонеальная химиотерапия. Концентрация химиопрепарата в 20~1000 раз выше чем при системной химиотерапии
На этой схеме видно, как высокие дозы химиопрепарата воздействуют на внешнюю оболочку опухоли
Гмпертермия. При нагревании раковых клеток до 43 градусов по Цельсию:
- гипоксическая и кислая среда меняются на гипероксию и повышается РН уровень. Это делает раковые клетки более восприимчивыми к химиотерапии и происходит избирательная деструкция клеток опухоли;
- структурные и сосудистые изменения при таких тепловых дозах приводят к усилению кровотока и ускорению доставки лекарств, экстравазации химиотерапии, а также высокой оксигенации тканей.
Эти изменения в опухолевых тканях повышают эффективность химио- и радиотерапии.
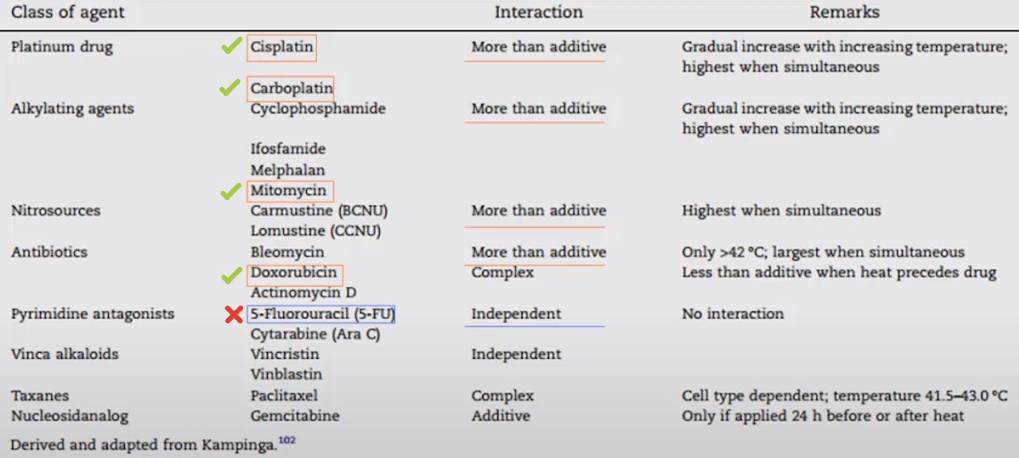
Гипертермия активирует иммунную систему — экспрессированный при гипертермии HSp70 активирует АРС и стимулирует пролиферацию цитотоксических Т‑клеток. Также предполагается что поверхностная экспрессия HSP активирует NK клетки некоторых опухолевых клетках. Препараты, применяемые при HIPEC, выбираются так, чтобы был усиливающий эффект совместно с гипертермией.
Внутрибрюшинное введение химиопрепаратов имеет:
- меньше побочных эффектов, таких как рост AUS, по сравнению с системной химиотерапией;
- позволяет проникать в опухолевую ткань глубже по сравнению с системной химиотерапией, на глубину до 3 мм.
HIPEC – гипертермическая интраперитонеальная химиотерапия
Первые статьи о HIPEC были опубликованы в 1980 году, для проведения процедуры необходимы термометр, роликовый насос, фильтр и нагреватель, для нагрева воды. Для лечения используется техника Колизея, как метод проведения HIPEC.
- Spratt JD, Adcock RA, Muskovin M, Sherrill W, McKeown J. Clinical delivery sistem for intraperitoneal hyperthermic chemotherape. Cancer Res. 1980 Feb$ 40(2); 256–60.
- Speyer GL, Meyers CE. The use of peritoneal dialysis for delivery of chemotherapy to intraperitoneal to intraperitoneal malingnacies. Recent Result Cancer Re. 1980; 74: 264–9.
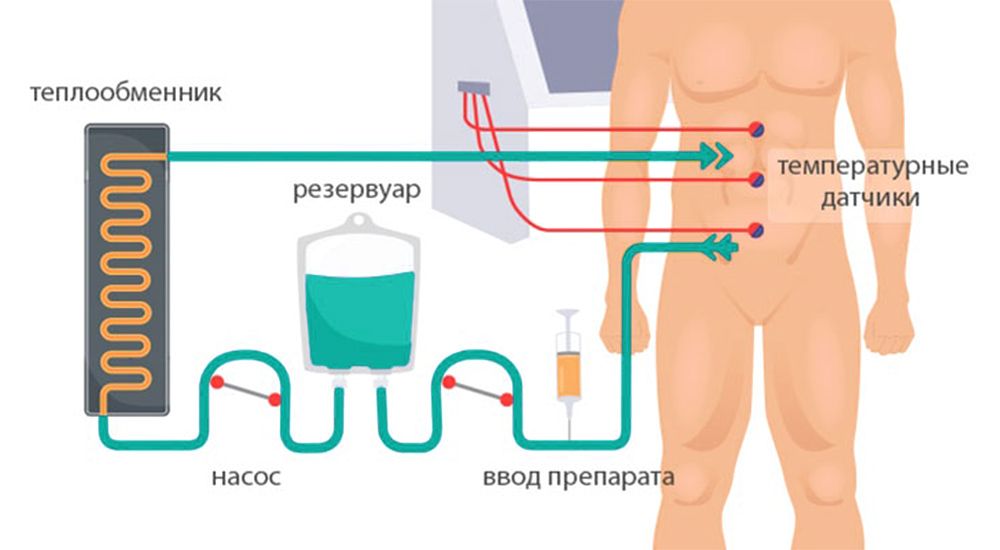
PCI – перитонеальный индекс рака – важный показатель для оценки перитонеального посева. Брюшную полость делят на 13 областей, каждой из которых присваивают определенное количество баллов, исходя из количества опухолевых образований. Суммарная оценка этих баллов (0–39) – представляет собой перитонеальный индекс рака.
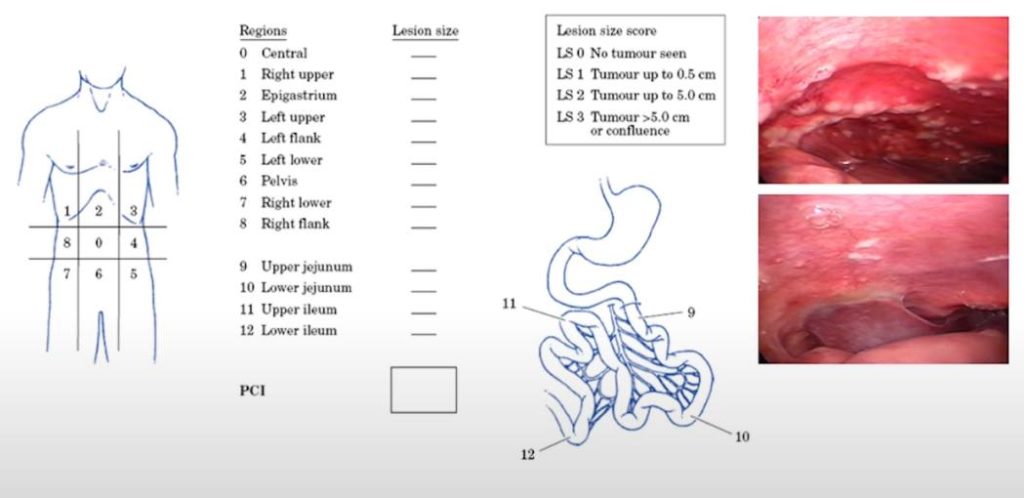
Классификация циторедуктивных вмешательств (СС0) – это оценка остаточной опухоли после максимальной циторезекции. Это основной прогностический индикатор выживаемости при раке брюшины. Существует 4 степени этой оценки в зависимости от объема остаточной опухоли в брюшине.
Смерть от циторедуктивной операции совместно с HIPEC (CRS HIPEC ) составляет 0–9%, серьезные осложнения возникают примерно у 27–65% пациентов.
У пациентов с перитонеальным метастазами рака желудка средняя выживаемость после CRS HIPEC составляет в среднем 11 месяцев. Эти результаты аналогичны результатам при проведении лишь химиотерапии. Поэтому в последнее время предпочитают многократное введение противоопухолевых препаратов в брюшную полость.
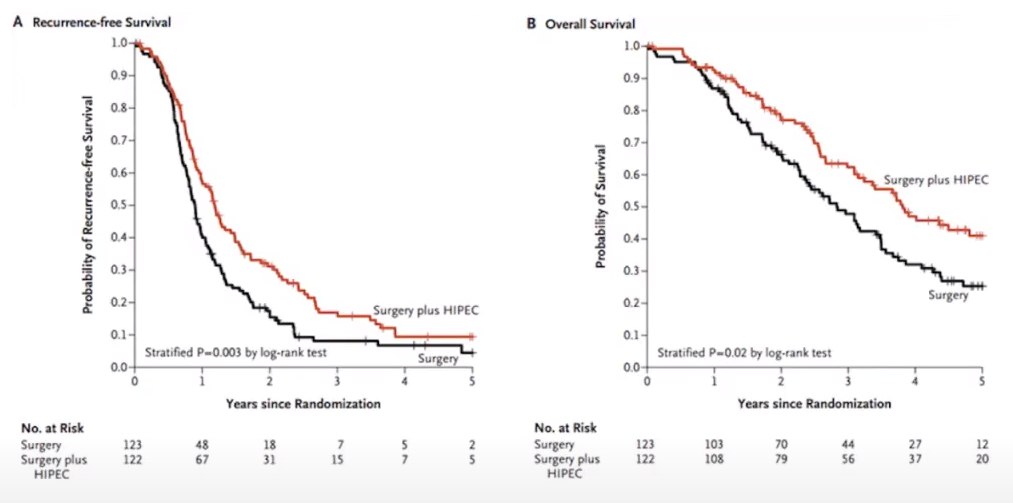
Результаты известного исследования применения CRS HIPEC при раке яичника. Сравнительное исследование было проведено между двумя группами – первой группе была проведена лишь циторедуктивная операция, второй группе после операции провели HIPEC. Исследование показало, что применение HIPEC после операции пациентам с эпителиальным раком яичников (3 стадия), помогает добиться более длительной общей выживаемости и отсутствия рецидивов. При этом не было установлено наличие большого количества побочных эффектов сравнительно с группой пациентов, которой проводили лишь циторедуктивную операцию. Результат этого исследования был добавлен в рекомендации NCCN.
- A – количество осложнений;
- B – выживаемость без рецидивов.
- Randomle assigned 245 patiets(CRS 123 vs. CRS+HIPEC 122)
- Neoadj TC#3 interval cytoreductive of HIPEC with cisplatin (100 mg per square meter)
Обновленная информация о лечении злокачественной мезотелиомы брюшины.
Шугар Бейкер известен своими исследованиями злокачественных новообразований брюшины.
- Предложил метод одновременного двунаправленного лечения с внутрибрюшным нормотемическим введением Алимта и системным введением Цисплатина с шестикратным повторением.
- Агрессивный хирургический подход совместно с регионарной химиотерапией увеличили среднюю выживаемость более чем на 5 лет.
- Сообщается, что при добавлении внутрибрюшной нормотемической химиотерапии, 5‑летняя выживаемость составляет 70%.
PRODIGY 7 – это рандомизированное исследование пациентов 3 стадии с перитонеальными метастазами колоректального рака.
Первой группе пациентов были проведены циторедуктивная операция и HIPEC с оксалиплатином, второй группе циторедуктивная операция и системная химиотерапия. Терапевтическое лечение пациентов с колоректальным раком с помощью циторедуктивной операции показало удовлетворительные результаты выживаемости, а добавление HIPEC с оксалиплатином не оказывает влияния на общую выживаемость.
Наиболее значительные недостатки HIPEC:
- однократной дозы, даже при использовании гипертермии, недостаточно для проникновения противоопухолевых препаратов в глубь метастатических очагов на поверхности брюшины;
- поэтому необходимо несколько процедур, чтобы вызвать заметное противоопухолевое действие на перитонеальную злокачественную опухоль.
LHIPEC – лапароскопическая гипертермическая интраперитонеальная химиотерапия
LHIPEC – это метод HIPEC, который проводится лапароскопическим методом. Он преследует 2 основные цели:
- лечение злокачественного асцита;
- пред– и послеоперационная терапия метастазов брюшины.
Самая первая публикация о LHIPEC вышла в 2001 году, все публикации показывают обнадеживающие результаты.

Онкологический центр доктора Андерсона представил результаты клинических испытаний LHIPEC при раке желудка.
Характерной особенностью этого исследования является то, что гастростомия проводилась после многократного лечения перитонеальных метастазов с помощью LHIPEC, что аналогично нашему методу лечения.
- Без LHIPEC средняя выживаемость равнялась 18,9 месяцев;
- Средняя выживаемость после лечения LHIPEC составила 30,2 месяца, при этом 25% больных сообщалось о том, что в дальнейшем возможна резекция резекция желудка.
Метод LHIPEC заключается в следующем: температуру внутрибрюшинного раствора повышаются до 43 градусов и обрабатывают им брюшину в течение 60–90 минут. Процедуру проводят каждые 4–5 недель. Вот например, схема двунаправленной химиотерапии для пациента с раком желудка. LHIPEC проводится каждые 4–5 недель, в зависимости от схемы лечения, между процедурами проводят системную химиотерапию.
В нашей больнице, за последние 10 лет, чаще всего процедура проводилась больным с раком яичников и колоректальным раком. Некоторым пациентам процедура проводилась 10 раз.
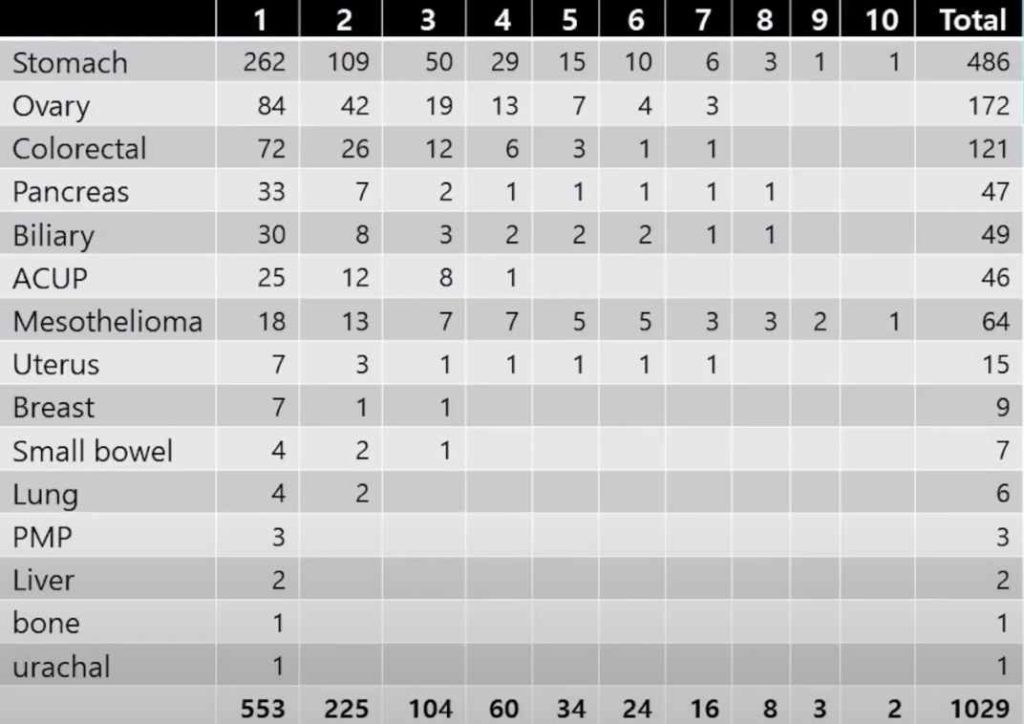
Результаты лечения пациентов с раком желудка
Клинический случай, пациентка 35 лет с раком желудка и метастатическим поражением брюшины.
- отмечено значительно уменьшилось после одной процедуры LHIPEC, после нее даже улучшилось состояние брыжейки
- исчезли многие мелкие опухолевые узелки в брыжейке и париетальной брюшине.
- метастатический узел полностью исчез после двух процедур и стала возможно радикальная резекция желудка.
Также проведенное исследование доказывает уменьшение объема злокачественного асцита. Количество внутрибрюшной жидкости уменьшилось на 72% после одной процедуры. По результатам изменения перитонеального индекса рака после нескольких процедур LHIPEC, при раке желудка он снизился на 61%.
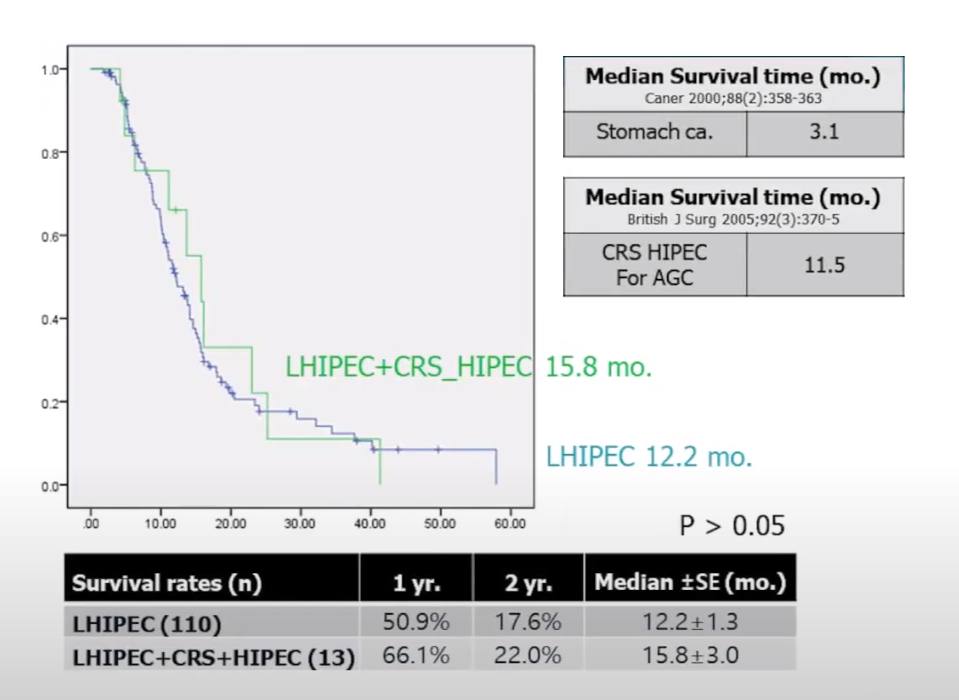
- средняя выживаемость пациентов с канцероматозом при раке раком желудка без лечения составляет 3.1 месяца;
- средняя выживаемость пациентов с раком желудка получивших лечение LHIPEC составила 12,2 месяца;
- за исключением 13 случаев, когда пациентам после LHIPEC провели циторедуктивную операцию с последующей процедурой HIPEC. Средняя выживаемость в этой группе составила 15,8 месяцев.
Это говорит о безопасности LHIPEC. Из 123 случаев не было ни одного, который бы закончился летальным исходом. Было 6 случаев с нежелательными побочными эффектами 3 степени и выше.
Результаты лечения пациентов с злокачественной мезотелиомой брюшины
У нас прошло лечение LHIPEC 18 пациентов с злокачественной мезотелиомой брюшины.
- продолжительность жизни при злокачественной мезотелиоме без LHIPEC составляет около года;
- средняя выживаемость наших пациентов – 23.5 месяцев.
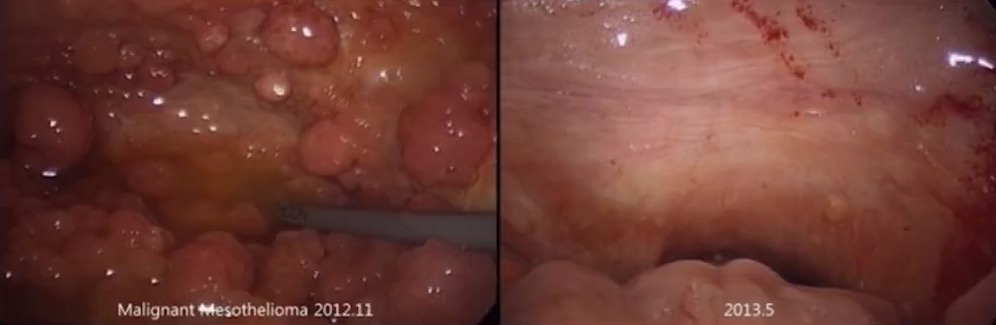
Пациенту, 71 года было проведено 8 процедур LHIPEC. Объем асцита в начале лечения – 6,5 л, после терапии он почти исчез, перитонеальные метастазы также значительно уменьшились. Большинство метастазов исчезли. Пациент прожил 25 месяцев со дня постановки диагноза.
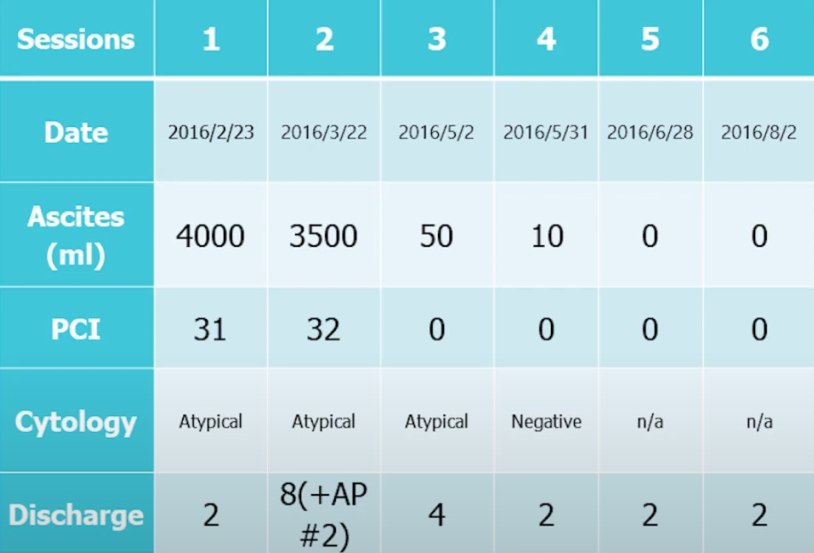
Пациенту, 55 лет проводилась одновременно химиотерапия и LHIPEC. Объем асцита составлял 4 л, после терапии асцит исчез, перитонеальные метастазы тоже почти исчезли. Его продолжительность жизни после постановки диагноза составила 5 лет.
Внутрибрюшинная химиотерапия необходима для лечения злокачественных новообразований брюшины. LHIPEC – это сравнительно безопасная процедура, которую можно проводить многократно. Хотя это пока окончательно не доказано, мы считаем, что LHIPEC имеет потенциальные преимущества в лечении пациентов с раком желудка и перитонеальным карциноматозом. Кроме этого процедура эффективна для лечения злокачественного асцита и улучшения перитонеального индекса рака.
Получить второе мнение врача
Заполните заявку, для получения экспертного мнения с планом лечения по вашему диагнозу от профессора Ли Чэён.



