Рак предстательной железы является одним из наиболее распространенных видов рака среди мужчин (после рака кожи), но чаще всего он успешно поддается лечению.
Рак предстательной железы возникает тогда, когда клетки предстательной железе начинают делиться и расти без контроля. Предстательная железа или простата представляет собой железу, характерную только для мужского пола. Она отвечает за выработку части семенной жидкости.
- Предстательная железа
- Насколько распространен рак простаты?
- Типы рака простаты
- Риск развития рака простаты
- Показатели выживаемости при раке простаты
- Что вызывает рак предстательной железы?
- Профилактика рака простаты
- Определение стадии рака простаты
- Лечение
- Наблюдение после лечения
- Реабилитация и качество жизни
Предстательная железа
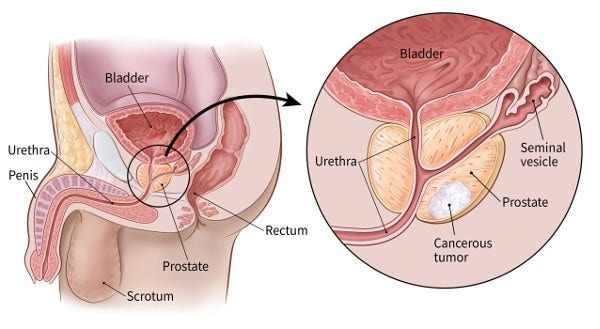
Простата представляет собой железу, имеющуюся только у мужчин. Она вырабатывает часть жидкости, которая входит в состав спермы.
Простата находится ниже мочевого пузыря и перед прямой кишкой. Сразу за простатой находятся железы, называемые семенными везикулами (семенными пузырьками), которые производят большую часть жидкости для спермы. Уретра (мочеиспускательный канал), представляющая собой трубку, которая переносит мочу и сперму из тела через половой член, проходит через центр простаты.
Простата имеет тенденцию расти по мере старения человека. У молодых мужчин она размером с грецкий орех, но у пожилых мужчин может быть намного больше.
Насколько распространен рак простаты?
По оценкам Американского онкологического общества, показатели по раку предстательной железы в Соединенных Штатах на 2025 год составляют:
- Около 313 780 новых случаев рака простаты.
- Около 35 770 смертей от рака простаты.
Количество случаев рака предстательной железы, диагностируемых каждый год, резко сократилось в период с 2007 по 2014 год, что совпало с уменьшением числа обследованных мужчин из-за изменений в рекомендациях по скринингу. Однако с 2014 года уровень заболеваемости увеличивался примерно на 3% в год.
Типы рака простаты
Почти все виды рака простаты являются аденокарциномами. Эти раковые заболевания развиваются из железистых клеток предстательной железы (клеток, которые производят секрет простаты, добавляемый в сперму).
Другие виды рака включают:
- Мелкоклеточная карцинома (мелкоклеточная нейроэндокринная карцинома).
- Другие нейроэндокринные опухоли (включая крупноклеточную карциному).
- Переходно-клеточная карцинома.
- Саркомы.
Эти виды рака встречаются редко. Если диагностирован рак предстательной железы, то в подавляющем большинстве случаев это будет аденокарцинома. Некоторые виды рака предстательной железы могут расти и распространяться быстро, но большинство из них, как правило, растут медленно.
Возможные предраковые состояния
Некоторые исследования показывают, что в ряде случаев рак предстательной железы может начинаться как предраковое состояние. Эти состояния иногда обнаруживаются при проведении биопсии простаты (процедуры извлечения мелких фрагментов ткани для поиска раковых клеток).
Простатическая интраэпителиальная неоплазия (PIN). При PIN клетки простаты под микроскопом выглядят аномально, но они не прорастают в другие части простаты (в отличие от раковых клеток). PIN не является раком, но иногда это состояние может указывать на более высокий риск развития заболевания. Основываясь на структуре клеток, PIN классифицируется как:
- PIN низкой степени: клетки кажутся почти нормальными.
- PIN высокой степени: клетки выглядят более аномальными.
Считается, что PIN низкой степени не связан с риском развития рака предстательной железы. При обнаружении PIN высокой степени риск развития рака со временем может быть выше, однако чаще всего PIN высокой степени не превращается в рак.
Пролиферативная воспалительная атрофия (PIA). При PIA клетки простаты выглядят меньше, чем обычно, и в этой области присутствуют признаки воспаления. PIA не является раком, и в настоящее время изучается вопрос о том, может ли это состояние приводить к PIN высокой степени или непосредственно к раку простаты.
Риск развития рака простаты
Примерно у одного из восьми мужчин в течение жизни диагностируется рак предстательной железы. Однако индивидуальный риск развития заболевания может варьироваться в зависимости от возраста, расы, этнической принадлежности и других факторов.
Возраст. Рак предстательной железы чаще развивается у пожилых мужчин. Около 6 из 10 случаев диагностируются в возрасте 65 лет и старше; заболевание редко встречается у мужчин младше 40 лет. Средний возраст на момент постановки диагноза составляет около 67 лет.
Раса и этническая принадлежность. Рак предстательной железы чаще развивается у афроамериканцев и мужчин африканского происхождения, чем у представителей других рас. При развитии заболевания у афроамериканцев оно часто диагностируется в более молодом возрасте и протекает в более агрессивной форме. Причины таких расовых различий до конца не ясны и могут быть связаны с генетическими особенностями, социально-экономическими факторами и доступом к медицинской помощи. У мужчин азиатского и латиноамериканского происхождения риск развития рака простаты ниже, чем у белых мужчин нелатиноамериканского происхождения.
География. Рак предстательной железы наиболее распространен в Северной Америке, Северо-Западной Европе, Австралии и на островах Карибского бассейна. Он менее распространен в Азии, Африке, Центральной и Южной Америке. Более частое выявление рака в развитых странах может быть частично обусловлено более интенсивным использованием скрининговых тестов, а также различиями в образе жизни, диете и факторах окружающей среды.
Семейная история. Похоже, что в некоторых семьях существует наследственная предрасположенность к раку простаты. Наличие отца или брата с этим заболеванием увеличивает риск его развития более чем в два раза (риск выше для мужчин, у которых брат болен раком простаты, чем для тех, у кого болен отец). Риск значительно возрастает, если заболевание диагностировано у нескольких родственников, особенно в молодом возрасте.
Генетические изменения. Некоторые унаследованные изменения генов (мутации) могут повышать риск развития рака простаты, но они составляют лишь небольшой процент случаев. Например, мутации в генах BRCA1 или BRCA2 (связанных с раком молочной железы и яичников) могут повышать риск заболевания у мужчин. Синдром Линча (наследственный неполипозный колоректальный рак) также может увеличивать риск развития ряда видов рака, включая рак простаты.
Показатели выживаемости при раке простаты
Показатели выживаемости дают представление о том, какой процент людей с тем же типом и стадией рака остается в живых через определенное время (обычно 5 лет) после постановки диагноза. Эти цифры не предсказывают продолжительность жизни конкретного человека, но помогают понять вероятность успешного лечения.
5‑летняя относительная выживаемость (на основе данных за 2014–2020 гг.):
- Локализованный рак (ограничен простатой): более 99%.
- Регионарный рак (распространился на соседние ткани или лимфоузлы): более 99%.
- Отдаленный рак (метастазы в легкие, печень или кости): 37%.
- Все стадии в совокупности: 97%.
Важно учитывать, что данные показатели основаны на результатах лечения мужчин, получивших диагноз как минимум пять лет назад. Современные методы лечения могут давать более благоприятные прогнозы. Кроме того, статистика не учитывает индивидуальные факторы, такие как возраст, сопутствующие заболевания и то, насколько успешно рак реагирует на терапию.
Другие факторы риска рака предстательной железы
Хотя основные факторы риска (возраст, раса и семейный анамнез) являются наиболее значимыми, изучаются и другие потенциальные причины развития заболевания.
Диета. Роль диеты в развитии рака предстательной железы до конца не ясна, но изучается несколько факторов. Мужчины, употребляющие большое количество красного мяса или молочных продуктов с высоким содержанием жира, по-видимому, имеют несколько более высокие шансы на развитие заболевания. В рационе таких лиц также часто присутствует меньше фруктов и овощей. Врачи не уверены, какой из этих факторов в большей степени влияет на повышение риска. Некоторые исследования показали, что высокое потребление кальция (через продукты или добавки) также может быть связано с повышенным риском развития агрессивного рака простаты.
Ожирение. Наличие избыточного веса или ожирения не повышает общий риск заболевания, но некоторые исследования показывают, что ожирение связано с более высоким риском развития агрессивных (быстрорастущих) форм рака предстательной железы. Причины этой связи не до конца понятны.
Курение. Большинство исследований не связывают курение напрямую с риском развития рака простаты. Однако некоторые данные указывают на то, что у курильщиков может быть несколько повышен риск смерти от этого заболевания.
Химические воздействия. Существуют доказательства того, что воздействие определенных химических веществ может повышать риск. Например, пожарные могут подвергаться воздействию соединений, увеличивающих вероятность развития заболевания.
Воспаление предстательной железы (простатит). Некоторые исследования предполагают наличие связи между простатитом (воспалением предстательной железы) и повышенным риском развития рака простаты, однако другие научные работы не подтверждают эту связь. Воспаление часто наблюдается в образцах ткани, где также присутствует рак, но связь между ними остается предметом изучения.
Инфекции, передающиеся половым путем (ИППП). Изучается возможность того, что ИППП (такие как гонорея или хламидиоз) могут повышать риск, вызывая хроническое воспаление простаты.
Вазэктомия. Некоторые исследования указывали на небольшое увеличение риска рака простаты после вазэктомии, но более поздние и крупные научные работы не подтвердили наличие этой связи.
Что вызывает рак предстательной железы?
Точные причины развития рака простаты остаются неизвестными. Исследователи обнаружили несколько факторов риска, но механизмы, посредством которых они трансформируют нормальные клетки в раковые, продолжают изучаться. На базовом уровне заболевание вызвано изменениями в ДНК клетки.
Генетические изменения. ДНК — это химическое вещество, из которого состоят гены. Гены управляют функциями клеток.
- Онкогены: Гены, стимулирующие рост и деление клеток.
- Гены-супрессоры опухолей: Гены, замедляющие деление клеток или запускающие их гибель в нужное время.
Рак может быть вызван мутациями ДНК, которые активируют онкогены или деактивируют гены-супрессоры опухолей. Изменения ДНК могут быть унаследованными или приобретенными.
Наследственные генные мутации. Считается, что наследственные изменения ДНК играют роль примерно в 10% случаев рака простаты. Наследственный рак часто развивается в более молодом возрасте. К генам, мутации в которых могут быть унаследованы, относятся:
- BRCA1 и BRCA2: Мутации в этих генах повышают риск рака груди и яичников у женщин, а также рака простаты у мужчин (особенно BRCA2).
- CHEK2, ATM, PALB2 и RAD51: Другие гены репарации ДНК, мутации в которых могут повышать риск.
- Гены системы восстановления несоответствия ДНК (такие как MSH2, MSH6, MLH1 и PMS2): Мутации в этих генах вызывают синдром Линча.
- RNASEL (ранее HPC1): Мутации в этом гене-супрессоре опухолей могут позволять аномальным клеткам выживать.
- HOXB13: Этот ген важен для развития предстательной железы. Мутации в нем связаны с ранним развитием рака простаты в некоторых семьях.
Приобретенные генные мутации. Большинство мутаций генов, связанных с раком простаты, развиваются в течение жизни человека, а не наследуются. Каждый раз, когда клетка готовится к делению, она должна копировать свою ДНК. В этом процессе могут возникать ошибки. Факторы, ускоряющие деление клеток (воспаление, высокий уровень гормонов), повышают вероятность таких ошибок. Например, мужские гормоны (андрогены), такие как тестостерон, способствуют росту клеток простаты. Наличие более высокого уровня андрогенов может способствовать развитию мутаций у некоторых мужчин.
Профилактика рака простаты
Поскольку точная причина заболевания неизвестна, невозможно гарантированно предотвратить рак предстательной железы. Однако риск может быть снижен.
Вес, физическая активность и диета. Влияние веса и диеты на риск развития заболевания до конца не изучено, но рекомендуется придерживаться следующих мер:
- Поддержание здорового веса.
- Регулярная физическая активность.
- Рацион, богатый фруктами, овощами и цельнозерновыми продуктами.
- Ограничение потребления красного и обработанного мяса, сахаросодержащих напитков и продуктов с высокой степенью переработки.
Витамины, минералы и другие добавки. Селен и витамин Е: Крупное исследование (SELECT) показало, что ни селен, ни витамин Е не снижают риск рака простаты. На самом деле у мужчин, принимавших добавки с витамином Е, риск был несколько выше. Соя и ликопин: Некоторые исследования предполагали пользу этих веществ, но на данный момент четких доказательств их эффективности в профилактике рака простаты не существует.
Лекарственные средства. Использование препаратов для снижения риска изучалось в ходе клинических испытаний. Ингибиторы 5‑альфа-редуктазы: Финастерид и дутастерид снижают уровень дигидротестостерона (ДГТ). Они могут снижать общий риск выявления рака простаты, но исследования показали, что мужчины, принимавшие эти препараты, имели более высокий риск развития агрессивных форм рака. Эти препараты не одобрены FDA специально для профилактики.
Генетическое консультирование и тестирование
Генетическое тестирование направлено на поиск унаследованных мутаций в генах, которые могут повышать риск развития рака предстательной железы.
Генетическое тестирование не является обязательным для всех, но его проведение рекомендуется рассмотреть в следующих случаях:
- При наличии семейной истории рака простаты (особенно в молодом возрасте) или других видов рака (груди, яичников, поджелудочной железы, толстой кишки).
- Если у родственника была обнаружена известная генетическая мутация (например, в гене BRCA2).
- При диагностике рака простаты, который уже распространился на другие части тела (метастатический рак).
- При диагностике рака простаты с определенными признаками высокой агрессивности (на основе группы градации по шкале Глисона).
Зачем проводить генетическое тестирование?
- Для пациента: Наличие определенных мутаций (например, в генах BRCA или генах системы восстановления несоответствия ДНК) может указывать на то, что некоторые виды таргетной терапии или химиотерапии будут более эффективны.
- Для семьи: Обнаружение наследственной мутации позволяет родственникам пациента также пройти тестирование, чтобы узнать, повышен ли у них риск развития рака.
Перед проведением таких тестов рекомендуется консультация с генетиком, который объяснит пользу и возможные риски получения результатов.
Раннее выявление рака простаты (Скрининг)
Скрининг — это обследование людей при отсутствии жалоб или симптомов заболевания. Основная цель скрининга на рак простаты — выявление опухоли на ранней стадии, когда лечение наиболее эффективно.
Основные тесты для скрининга:
- Анализ крови на ПСА (простат-специфический антиген): ПСА — это белок, вырабатываемый клетками предстательной железы. При наличии рака уровень ПСА в крови часто повышается. Однако повышение ПСА не всегда означает рак (оно может быть вызвано инфекцией или доброкачественным увеличением железы).
- Пальцевое ректальное исследование (DRE): Во время этого обследования врач прощупывает предстательную железу через стенку прямой кишки для поиска уплотнений или аномалий.
Решение о начале скрининга должно приниматься индивидуально после обсуждения с врачом всех преимуществ и рисков. Общие рекомендации обычно включают:
- С 50 лет: Для мужчин со средним риском и ожидаемой продолжительностью жизни не менее 10 лет.
- С 45 лет: Для мужчин с высоким риском (афроамериканцы, а также мужчины, у которых отец или брат заболели раком простаты в возрасте до 65 лет).
- С 40 лет: Для мужчин с очень высоким риском (наличие более одного родственника первой степени родства, заболевших раком простаты в молодом возрасте).
Если при первом обследовании уровень ПСА составляет менее 2,5 нг/мл, повторное тестирование может проводиться каждые 2 года. Если уровень ПСА выше, обычно рекомендуется ежегодное обследование.
Скрининг не является совершенным инструментом:
- Гипердиагностика: Тесты могут обнаружить медленнорастущие опухоли, которые никогда не причинили бы вреда здоровью в течение жизни человека. Лечение таких опухолей может привести к ненужным побочным эффектам.
- Ложноположительные результаты: Повышенный уровень ПСА часто ведет к проведению биопсии, которая в итоге может не выявить рак. Это вызывает психологический стресс и риск осложнений после процедуры.
- Ложноотрицательные результаты: В редких случаях уровень ПСА остается нормальным даже при наличии агрессивного рака.
Если уровень ПСА повышен или при ректальном исследовании обнаружены изменения, могут быть назначены дополнительные тесты:
- Повторный анализ на ПСА через некоторое время.
- Специальные виды тестов на ПСА (свободный ПСА, индекс здоровья простаты PHI и др.).
- МРТ предстательной железы (мультипараметрическое МРТ).
- Биопсия простаты: Единственный способ точно подтвердить наличие раковых клеток.
Определение стадии рака простаты
Стадия рака предстательной железы описывает распространенность опухолевого процесса в организме. Это один из ключевых факторов, используемых для определения оптимальной тактики лечения. Врачи также опираются на стадию рака при обсуждении прогнозов и статистики выживаемости.
Определение стадии основано на результатах диагностических тестов, включая уровень ПСА в крови, результаты биопсии простаты (шкала Глисона), а также данные методов визуализации (МРТ, КТ, сцинтиграфия костей), если они проводились.
Система стадирования AJCC TNM
Наиболее широко используемой системой для описания распространенности рака предстательной железы является система TNM, разработанная Американским объединенным комитетом по раку (AJCC). Последнее значимое обновление системы было проведено в 2018 году.
Система TNM для рака предстательной железы базируется на 5 ключевых элементах информации:
- Категория T (Tumor): Степень распространения основной (первичной) опухоли.
- Категория N (Nodes): Наличие или отсутствие рака в близлежащих (регионарных) лимфатических узлах.
- Категория M (Metastasis): Наличие или отсутствие метастазов в отдаленных частях тела.
- Уровень ПСА: Значение простат-специфического антигена в крови на момент постановки диагноза.
- Группа градации (Grade Group): Оценка агрессивности опухоли на основе гистологического исследования (балл по шкале Глисона). Этот показатель отражает вероятность быстрого роста и распространения рака.
Категории T (Опухоль)
Существует два типа категорий T для рака простаты:
- Клиническая категория T (обозначается как cT): Это оценка степени распространения рака, основанная на результатах физикального осмотра (включая пальцевое ректальное исследование), результатах биопсии и данных визуализационных тестов.
- Патологическая категория T (обозначается как pT): Определяется в случае проведения операции по удалению простаты (радикальной простатэктомии). Патологический показатель T является более точным, так как устанавливается после детального лабораторного изучения всей удаленной железы.
Цифры или буквы после T, N и M предоставляют более подробную информацию о каждом из этих факторов. Более высокие цифры означают, что рак является более запущенным.
Группировка стадий
После того как определены категории T, N и M, эта информация объединяется с уровнем ПСА и Группой градации для определения общей стадии рака. Этот процесс называется группировкой стадий.
Основные стадии рака простаты обозначаются римскими цифрами от I (1) до IV (4). Некоторые стадии разделяются на подстадии (IIA, IIB, IIC и т. д.).
- Правило стадирования: Чем меньше число, тем меньше рак распространился по организму. Стадия IV означает значительное распространение заболевания. В пределах одной стадии буква, стоящая раньше по алфавиту, указывает на более раннюю подстадию.
Несмотря на уникальность каждого клинического случая, заболевания со схожими стадиями обычно имеют похожий прогноз и зачастую лечатся одинаковыми методами.
Понимание сложности стадирования
Система стадирования рака предстательной железы является сложной. При возникновении вопросов относительно установленной стадии рекомендуется обратиться к лечащему врачу для получения разъяснений в доступной форме.
Хотя стадия помогает составить представление о серьезности заболевания и выбрать метод лечения, современная медицина также использует дополнительные способы оценки того, насколько вероятно дальнейшее прогрессирование рака (например, определение групп риска).
Стадия I . На этой стадии опухоль обычно растет медленно. Рак не распространился на близлежащие лимфатические узлы (N0) или в отдаленные части тела (M0).
- Критерии:
- Врач не может прощупать опухоль при ректальном исследовании или увидеть её на УЗИ. Опухоль обнаружена случайно при операции по поводу аденомы (ТУРП) или при биопсии из-за высокого ПСА (cT1). ПСА менее 10, Группа градации 1 (Глисон 6 или менее).
ИЛИ - Опухоль может ощущаться при ректальном осмотре или видна на УЗИ, но она занимает не более половины одной стороны (доли) простаты (cT2a). ПСА менее 10, Группа градации 1.
ИЛИ - Простата была удалена хирургическим путем, и опухоль обнаружена только в пределах органа (pT2). ПСА менее 10, Группа градации 1.
- Врач не может прощупать опухоль при ректальном исследовании или увидеть её на УЗИ. Опухоль обнаружена случайно при операции по поводу аденомы (ТУРП) или при биопсии из-за высокого ПСА (cT1). ПСА менее 10, Группа градации 1 (Глисон 6 или менее).
Стадия IIA. Рак не вышел за пределы простаты и не распространился на лимфоузлы или другие органы.
- Критерии:
- Опухоль не прощупывается и не видна на УЗИ (cT1), но уровень ПСА составляет от 10 до 20 нг/мл. Группа градации 1.
ИЛИ - Опухоль прощупывается или видна на УЗИ, находится в пределах одной доли (cT2a) или простата удалена и рак ограничен органом (pT2). Уровень ПСА от 10 до 20 нг/мл. Группа градации 1.
- Опухоль не прощупывается и не видна на УЗИ (cT1), но уровень ПСА составляет от 10 до 20 нг/мл. Группа градации 1.
Стадия IIB. Рак не распространился на лимфоузлы или отдаленные органы.
- Критерии:
Опухоль может прощупываться (или не прощупываться), она может занимать обе доли простаты (cT1, cT2b, cT2c или pT2). Уровень ПСА менее 20 нг/мл. Ключевым отличием является Группа градации 2 (показатель Глисона 3+4=7).
Стадия IIC. Рак все еще ограничен простатой.
- Критерии:
Опухоль любого размера в пределах органа (T1 или T2). ПСА менее 20 нг/мл. Ключевым отличием является Группа градации 3 или 4 (показатель Глисона 4+3=7 или 8).
Стадия IIIA. Рак не распространился на лимфоузлы или отдаленные органы.
- Критерии:
Опухоль находится в пределах простаты (T1 или T2). Группа градации 1–4. Основной признак стадии IIIA — уровень ПСА не менее 20 нг/мл.
Стадия IIIB. Рак пророс за пределы простаты (T3 или T4), но не затронул лимфоузлы или отдаленные органы.
- Критерии:
Опухоль распространилась на семенные пузырьки (T3), либо на другие ткани рядом с простатой, такие как сфинктер мочеиспускательного канала, прямая кишка, мочевой пузырь или стенка таза (T4). Уровень ПСА может быть любым, Группа градации — от 1 до 4.
Стадия IIIC. Рак может как находиться в пределах простаты, так и прорастать в соседние ткани (любой T). Лимфоузлы и отдаленные органы не поражены.
- Критерии:
Уровень ПСА может быть любым. Ключевым признаком является Группа градации 5 (наиболее агрессивные клетки, показатель Глисона 9 или 10).
Стадия IVA. Рак распространился на близлежащие (регионарные) лимфатические узлы (N1), но не обнаружен в отдаленных частях тела (M0). Опухоль в простате может быть любого размера, уровень ПСА и Группа градации могут иметь любое значение.
Стадия IVB. Это стадия с отдаленными метастазами (M1). Рак распространился в отдаленные лимфатические узлы, кости, легкие или другие органы. Категории T, N, уровень ПСА и Группа градации могут быть любыми.
Для стадий с I по III врачи используют не только систему TNM, но и деление на группы риска. Это помогает более точно определить вероятность того, что рак будет расти и распространяться, а также решить, необходимо ли немедленное лечение или можно применить тактику наблюдения.
Система распределения по группам риска (наиболее часто используется классификация NCCN) учитывает уровень ПСА, Группу градации (балл по Глисону) и клиническую стадию (категория T).
Группа очень низкого риска. К этой группе относится рак, который практически не имеет шансов на быстрый рост или распространение.
- Критерии: Опухоль не прощупывается при осмотре (T1c), Группа градации 1 (Глисон 6), уровень ПСА менее 10 нг/мл. Кроме того, рак обнаруживается менее чем в 3 образцах (столбиках) биопсии, и в каждом из них поражено не более 50% ткани.
- Тактика: Обычно рекомендуется активное наблюдение.
Группа низкого риска.Опухоль все еще ограничена простатой и имеет низкую вероятность прогрессирования.
- Критерии: Стадия T1–T2a, Группа градации 1 (Глисон 6), уровень ПСА менее 10 нг/мл.
Группа среднего (промежуточного) риска. Эта группа разделяется на две подгруппы, так как прогнозы для них различаются:
- Благоприятный средний риск: Имеется только один фактор среднего риска (например, ПСА 10–20 или Группа градации 2), и при биопсии обнаружено менее половины положительных образцов.
- Неблагоприятный средний риск: Имеется несколько факторов среднего риска, Группа градации 3 (Глисон 4+3=7) или поражено более половины образцов ткани при биопсии.
Группа высокого риска. Рак имеет более высокую вероятность распространения за пределы простаты или рецидива после лечения.
- Критерии: Стадия T3a, ИЛИ Группа градации 4 или 5 (Глисон 8, 9 или 10), ИЛИ уровень ПСА более 20 нг/мл.
Группа очень высокого риска. Сюда относятся опухоли с наиболее агрессивным течением.
- Критерии: Стадия T3b (прорастание в семенные пузырьки) или T4 (прорастание в другие соседние органы), Группа градации 4 или 5 в большинстве образцов биопсии, либо наличие более двух факторов высокого риска.
Другие факторы, влияющие на прогноз
Помимо стадии и группы риска, существуют и другие параметры, помогающие врачам составить прогноз:
Ожидаемая продолжительность жизни. Это важный фактор при выборе между активным наблюдением и радикальным лечением. Если ожидаемая продолжительность жизни составляет менее 10 лет (из-за возраста или сопутствующих болезней), врачи чаще предлагают тактику наблюдения, так как рак простаты часто растет десятилетиями, не вызывая смерти.
Результаты молекулярно-генетических тестов (геномное профилирование). В некоторых случаях на образцах ткани, полученных при биопсии или после операции, проводятся специальные тесты (например, Decipher, Oncotype DX Prostate или Prolaris). Эти тесты анализируют активность определенных генов в раковых клетках, чтобы более точно предсказать, насколько агрессивным будет заболевание. Это помогает в ситуациях «серой зоны», когда неясно, нужно ли усиливать терапию.
Лечение
Поскольку рак предстательной железы часто растет очень медленно, не всем мужчинам с этим диагнозом требуется немедленное лечение. Это особенно актуально для опухолей, которые имеют малый размер, ограничены пределами железы и не вызывают симптомов. Для таких случаев существуют две основные стратегии наблюдения.
Активное наблюдение (Active Surveillance). Активное наблюдение подразумевает тщательный мониторинг рака без проведения немедленного лечения (такого как хирургическое вмешательство или лучевая терапия). Этот подход позволяет избежать побочных эффектов лечения до тех пор, пока они не станут абсолютно необходимыми.
- Как проводится: Мониторинг обычно включает регулярные анализы крови на ПСА (примерно каждые 6 месяцев) и пальцевое ректальное исследование (не реже одного раза в год). Также могут периодически проводиться повторные биопсии простаты (через 6–12 месяцев после первой, а затем каждые 2–5 лет) и МРТ-исследования.
- Цель: Если результаты тестов показывают, что рак начинает расти быстрее или становится более агрессивным, пациенту предлагается активное лечение (операция или облучение) с целью полного излечения.
- Для кого подходит: В основном для мужчин с раком очень низкого или низкого риска, а также в некоторых случаях благоприятного среднего риска.
Динамическое наблюдение (Watchful Waiting). Этот метод иногда путают с активным наблюдением, но он имеет иную цель и менее интенсивный график обследований. Динамическое наблюдение больше ориентировано на контроль симптомов, а не на полное излечение рака.
- Как проводится: Обследования проводятся реже и включают меньше тестов (обычно только ПСА и осмотры при появлении жалоб). Повторные биопсии, как правило, не проводятся.
- Цель: Лечение назначается только в том случае, если рак начинает вызывать симптомы, такие как боль или затрудненное мочеиспускание. В этом случае применяются методы паллиативной терапии (например, гормональное лечение) для сдерживания болезни и улучшения самочувствия.
- Для кого подходит: Обычно рекомендуется пожилым мужчинам или лицам с серьезными сопутствующими заболеваниями, при которых ожидаемая продолжительность жизни составляет менее 10 лет, и риск от радикального лечения превышает потенциальную пользу.
Преимущества и риски тактики наблюдения
Преимущества:
- Отсутствие побочных эффектов, связанных с операцией или облучением (таких как недержание мочи или эректильная дисфункция).
- Сохранение привычного качества жизни на максимально долгий срок.
Риски:
- Вероятность того, что рак может распространиться за пределы простаты в период между обследованиями, что может ограничить шансы на полное излечение в будущем.
- Психологический дискомфорт от осознания наличия опухоли в организме без проведения активного лечения.
Решение о выборе между активным наблюдением и немедленным лечением должно приниматься на основе группы риска, общего состояния здоровья и личных предпочтений после детального обсуждения с лечащим врачом.
Хирургическое лечение: Радикальная простатэктомия
Радикальная простатэктомия — это хирургическая операция, при которой удаляется вся предстательная железа вместе с семенными пузырьками и, в ряде случаев, близлежащими лимфатическими узлами. Основной целью операции является полное избавление от рака.
Когда применяется хирургическое лечение:
Операция обычно рассматривается как основной вариант лечения в следующих случаях:
- Рак ограничен только пределами предстательной железы (стадии I или II).
- Рак пророс за пределы капсулы, но все еще считается операбельным (некоторые случаи стадии III).
- Пациент находится в хорошей физической форме, и ожидаемая продолжительность жизни составляет более 10 лет.
Для мужчин с метастатическим раком (стадия IV) простатэктомия обычно не рекомендуется в качестве стандартного лечения, однако она может применяться в рамках клинических испытаний или для облегчения определенных симптомов.
Виды радикальной простатэктомии
Существует несколько подходов к выполнению данной операции:
1. Робот-ассистированная лапароскопическая простатэктомия
На сегодняшний день это наиболее распространенный метод. Хирург выполняет операцию через несколько небольших разрезов в брюшной стенке, используя роботизированную систему. Хирург управляет манипуляторами робота, сидя за специальной консолью, которая обеспечивает 3D-изображение высокой четкости и высокую точность движений.
- Преимущества: Меньшая кровопотеря, менее выраженный болевой синдром после операции и более быстрое восстановление по сравнению с открытой операцией.
2. Открытая радикальная простатэктомия
Хирург делает один длинный разрез для удаления простаты. В зависимости от расположения разреза выделяют:
- Позадилонный доступ: Разрез делается в нижней части живота. Этот метод позволяет одновременно удалить лимфатические узлы таза для проверки на наличие рака.
- Промежностный доступ: Разрез делается в области между мошонкой и анусом. Применяется реже, так как при этом доступе сложнее удалить лимфоузлы, но восстановление может быть быстрее.
Нервосберегающая техника
Во время любой простатэктомии хирурги стремятся сохранить пучки нервов, которые проходят по бокам от простаты и отвечают за эрекцию. Если опухоль расположена слишком близко к нервам, их приходится удалять вместе с частью тканей. Сохранение нервов значительно повышает шансы на восстановление половой функции после операции.
Возможные побочные эффекты хирургического лечения
Как и любая серьезная операция, простатэктомия сопряжена с рисками. К основным долгосрочным побочным эффектам относятся:
Недержание мочи. Неспособность полностью контролировать мочеиспускание является частым осложнением после удаления простаты. Обычно контроль восстанавливается в течение нескольких месяцев, но в некоторых случаях проблема может сохраняться. Существует несколько видов недержания, наиболее частым из которых является стрессовое (подтекание при кашле, смехе или физической нагрузке).
Эректильная дисфункция (импотенция). Потеря способности достигать эрекции, достаточной для полового акта, встречается часто. Вероятность восстановления зависит от возраста пациента, состояния функции до операции и того, были ли сохранены нервы. Для реабилитации могут использоваться медикаментозные средства или вакуумные устройства.
Бесплодие. После удаления простаты и семенных пузырьков эякуляция становится «сухой», так как жидкость больше не вырабатывается. Это приводит к бесплодию.
Лимфедема. Если в ходе операции были удалены лимфатические узлы, это может привести к отекам ног или паховой области из-за нарушения оттока лимфы. Это редкое, но требующее лечения состояние.
Паховая грыжа. Мужчины, перенесшие радикальную простатэктомию, имеют несколько более высокий риск развития паховой грыжи в будущем.
Лучевая терапия (Радиотерапия)
Лучевая терапия использует высокоэнергетическое излучение (рентгеновские лучи или протоны) для уничтожения раковых клеток. Данный метод может применяться в различных ситуациях:
- В качестве основного лечения рака, ограниченного простатой (стадии I–II) или проросшего в соседние ткани (стадия III). Показатели эффективности при этом сопоставимы с хирургическим лечением.
- В сочетании с гормональной терапией при раке с высоким риском прогрессирования.
- После операции (адъювантная терапия), если рак не был удален полностью или возник рецидив в области ложа простаты.
- Для облегчения симптомов при метастатическом раке (стадия IV), например, для уменьшения боли в костях.
Основные виды лучевой терапии
1. Дистанционная лучевая терапия (EBRT)
Облучение направляется на предстательную железу из источника, расположенного вне тела. Современные технологии позволяют фокусировать лучи максимально точно, минимизируя повреждение мочевого пузыря и прямой кишки.
- Конформная лучевая терапия (3D-CRT): Использование компьютеров для точного сопоставления формы лучей с формой простаты.
- Лучевая терапия с модулированной интенсивностью (IMRT): Самый распространенный метод, позволяющий регулировать интенсивность лучей, что дает возможность доставлять более высокую дозу радиации в опухоль, защищая здоровые ткани.
- Стереотаксическая лучевая терапия тела (SBRT): Использование очень высоких доз радиации за несколько сеансов (обычно около 5 дней вместо стандартных 8–9 недель).
- Протонная терапия: Вместо рентгеновских лучей используются пучки протонов. Теоретически это позволяет еще точнее доставлять дозу, однако значительное преимущество перед IMRT в лечении рака простаты пока не доказано.
2. Брахитерапия (внутренняя лучевая терапия)
Радиоактивные источники (в виде маленьких «зерен» или гранул) вводятся непосредственно в ткань предстательной железы с помощью игл под контролем УЗИ.
- Постоянная брахитерапия (LDR): Маленькие гранулы остаются в простате навсегда, постепенно теряя радиоактивность в течение нескольких месяцев.
- Временная брахитерапия (HDR): В простату на короткое время вводятся источники с высокой мощностью излучения через катетеры, после чего они извлекаются. Обычно проводится 1–4 сеанса.
Побочные эффекты лучевой терапии
Побочные эффекты часто развиваются постепенно и могут сохраняться в течение длительного времени.
Проблемы с кишечником (лучевой проктит). Могут возникнуть диарея, наличие крови в стуле, болезненные позывы к дефекации или раздражение прямой кишки. В большинстве случаев эти симптомы проходят со временем, но иногда требуют лечения.
Проблемы с мочеиспусканием (лучевой цистит). Возможно учащенное мочеиспускание, чувство жжения или наличие крови в моче. Недержание мочи встречается реже, чем после операции, но риск сохраняется.
Эректильная дисфункция. Проблемы с эрекцией после облучения обычно развиваются не сразу, а в течение 1–2 лет. Вероятность их возникновения в долгосрочной перспективе примерно такая же, как после хирургического вмешательства.
Общая утомляемость. Сильная усталость является частым побочным эффектом, который обычно проходит через несколько недель или месяцев после завершения курса лечения. Уретральная стриктура. В редких случаях облучение может привести к рубцеванию и сужению мочеиспускательного канала, что затрудняет отток мочи и требует проведения дополнительных процедур.
Гормональная терапия рака предстательной железы
Гормональная терапия также называется терапией подавления андрогенов. Целью этого лечения является снижение уровня мужских гормонов (андрогенов) в организме или предотвращение их воздействия на клетки рака простаты.
Основными андрогенами являются тестостерон и дигидротестостерон (ДГТ). Большая часть андрогенов вырабатывается яичками, но небольшое их количество также производится надпочечниками. Андрогены стимулируют рост клеток рака предстательной железы. Снижение уровня этих гормонов или блокирование их действия часто заставляет опухоль уменьшаться или расти медленнее в течение определенного времени.
Когда применяется гормональная терапия:
- Если рак распространился слишком далеко, чтобы его можно было вылечить с помощью хирургии или облучения, или если проведение этих процедур невозможно по другим причинам.
- Если рак сохраняется или возвращается после хирургического вмешательства или лучевой терапии.
- Вместе с лучевой терапией в качестве первоначального лечения, если риск рецидива рака высок (на основе группы риска).
- Перед лучевой терапией (неоадъювантная терапия), чтобы попытаться уменьшить опухоль и сделать облучение более эффективным.
Виды гормональной терапии
1. Методы снижения уровня андрогенов в яичках
- Агонисты лютеинизирующего гормона-рилизинг-гормона (ЛГРГ): эти препараты снижают количество тестостерона, вырабатываемого яичками. Лечение агонистами ЛГРГ иногда называют химической кастрацией, так как они снижают уровень андрогенов так же эффективно, как и хирургическое вмешательство. Препараты вводятся в виде инъекций или имплантатов под кожу с разной периодичностью (от одного раза в месяц до одного раза в год). Примеры: лейпролид, гозерелин, трипторелин и гистрелин. При первом введении агонистов ЛГРГ уровень тестостерона может кратковременно повыситься («вспышка»), прежде чем упадет до очень низкого уровня. Для предотвращения этого в течение первых недель приема могут назначаться антиандрогены.
- Антагонисты ЛГРГ: эти препараты действуют быстрее, чем агонисты ЛГРГ, и не вызывают временного повышения уровня тестостерона («вспышки»). Примеры: дегареликс (инъекция) и релуголикс (пероральные таблетки).
- Орхиэктомия (хирургическая кастрация): Хирургическое удаление яичек. Хотя это операция, основной её эффект является гормональным. Это наиболее простой и экономичный способ снижения уровня тестостерона, эффект от которого является постоянным и наступает немедленно.
2. Методы снижения уровня андрогенов из других источников
Даже после удаления яичек или приема препаратов ЛГРГ надпочечники и сами раковые клетки могут продолжать вырабатывать небольшое количество андрогенов.
- Ингибиторы синтеза андрогенов (например, абиратерон): этот препарат блокирует фермент CYP17, который помогает клеткам вырабатывать андрогены. Абиратерон принимается в виде таблеток ежедневно. Он часто назначается мужчинам с распространенным раком с высоким риском прогрессирования или в тех случаях, когда стандартная гормональная терапия перестала работать.
3. Препараты, блокирующие действие андрогенов (Антиандрогены)
Вместо того чтобы снижать уровень гормонов, эти препараты блокируют способность раковых клеток использовать любые доступные андрогены, присоединяясь к рецепторам андрогенов в клетках.
- Антиандрогены первого поколения: Флутамид, бикалутамид и нилутамид. Часто используются в сочетании с орхиэктомией или агонистами ЛГРГ (комбинированная андрогенная блокада).
- Антиандрогены второго поколения: Энзалутамид, апалутамид и даролутамид. Эти препараты более эффективны и часто используются при раке, который перестал отвечать на другие виды гормонального лечения, или при наличии метастазов.
Побочные эффекты гормональной терапии
Снижение уровня андрогенов может привести к различным побочным эффектам, включая:
- Снижение или отсутствие полового влечения (либидо) и эректильную дисфункцию.
- Приливы (внезапное чувство жара).
- Увеличение грудных желез (гинекомастия) и болезненность в этой области.
- Остеопороз (ослабление костей), что может привести к переломам.
- Усталость, увеличение веса и потерю мышечной массы.
- Повышение уровня холестерина и риск развития диабета или сердечно-сосудистых заболеваний.
- Депрессию или изменения настроения.
Химиотерапия при раке предстательной железы
Химиотерапия подразумевает использование лекарственных препаратов, вводимых внутривенно или перорально, которые распространяются по кровотоку и уничтожают раковые клетки во всем организме. Этот метод применяется в тех случаях, когда рак предстательной железы распространился за пределы простаты и гормональная терапия перестала быть эффективной (кастрационно-резистентный рак простаты).
Химиотерапия не ставит целью полное излечение рака на поздних стадиях, но она может помочь пациентам жить дольше, уменьшить размер опухолей и облегчить симптомы, такие как боль в костях.
Основные химиопрепараты:
- Доцетаксел: Обычно является первым препаратом, который назначается при прогрессирующем раке. Он часто используется вместе с кортикостероидными препаратами (например, преднизолоном).
- Кабазитаксел: Часто назначается, если доцетаксел больше не помогает или не может быть использован.
- Митоксантрон: Применяется реже, в основном для уменьшения боли в костях, когда другие методы лечения неэффективны.
Иммунотерапия
Иммунотерапия использует собственные защитные силы организма для борьбы с раковыми клетками.
Вакцина Sipuleucel‑T (Provenge). В отличие от обычных вакцин, предотвращающих инфекции, Sipuleucel‑T используется для лечения уже имеющегося рака простаты. Она изготавливается индивидуально для каждого пациента:
- Из крови пациента извлекаются иммунные клетки.
- В лаборатории их подвергают воздействию белка, характерного для рака простаты, чтобы «научить» их распознавать опухоль.
- Активированные клетки вводятся обратно пациенту внутривенно.
Этот метод может продлить жизнь мужчинам с распространенным раком, у которых наблюдается мало симптомов или они отсутствуют вовсе.
Таргетная терапия (Целевая терапия)
Таргетная терапия воздействует на специфические молекулы или механизмы внутри раковых клеток, которые позволяют им расти и выживать.
Ингибиторы PARP. Некоторые виды рака простаты имеют изменения (мутации) в генах, отвечающих за восстановление поврежденной ДНК (например, BRCA1, BRCA2 или ATM). Препараты: Олапариб, рукапариб, нирапариб и талазопариб. Эти лекарства блокируют белок PARP, который помогает клеткам чинить ДНК. Когда PARP заблокирован в клетках с уже имеющимися дефектами репарации, раковые клетки погибают, не имея возможности восстановить свой генетический код.
Ингибиторы PARP часто используются вместе с гормональной терапией при прогрессирующем заболевании.
Моноклональные антитела. Это искусственно созданные белки иммунной системы, разработанные для прикрепления к специфическим мишеням на раковых клетках, таким как белок PSMA (простат-специфический мембранный антиген).
В настоящее время большинство исследуемых антител связаны либо с химиопрепаратами, либо с радиоактивными молекулами. Идея заключается в том, что антитело действует как «самонаводящееся устройство», доставляя разрушительную дозу лекарства или радиации непосредственно в раковую клетку, минимизируя повреждение здоровых тканей.
Лечение рака, распространившегося на кости
Когда рак простаты дает метастазы, он чаще всего поражает кости. Это может привести к сильной боли и переломам. Для борьбы с этим используются следующие подходы:
- Радиофармпрепараты (Радий-223, Стронций-89, Самарий-153): Вещества, содержащие радиоактивные элементы, которые вводятся внутривенно и накапливаются в участках костей с метастазами, уничтожая раковые клетки радиацией.
- Бисфосфонаты и Деносумаб: Лекарства, помогающие укрепить кости и снизить риск переломов.
- Абляционные методы: Использование экстремальных температур для разрушения опухолевых очагов в кости.
- Высокоинтенсивный сфокусированный ультразвук (HIFU).
- Радиочастотная абляция (RFA).
- Криоабляция (замораживание опухоли).
Обсуждение лечения с медицинским персоналом
При постановке диагноза «рак предстательной железы» важно получить максимально полную информацию для принятия взвешенного решения. Рекомендуется обсудить с лечащим врачом все доступные варианты, учитывая стадию заболевания, группу риска и общее состояние здоровья.
Вопросы, которые следует задать перед началом лечения:
- Какова точная клиническая стадия заболевания и группа риска?
- Каков показатель по шкале Глисона (Группа градации) и уровень ПСА?
- Какова вероятность того, что рак вышел за пределы капсулы предстательной железы?
- Какова ожидаемая эффективность предлагаемого метода лечения в данном конкретном случае?
- Каковы основные риски и возможные побочные эффекты (недержание мочи, эректильная дисфункция, проблемы с кишечником)?
- Каков опыт хирурга или радиолога в проведении данных процедур?
- Какие существуют альтернативные методы лечения (например, переход от хирургии к лучевой терапии или активному наблюдению)?
- Какова вероятность рецидива после завершения курса лечения?
Наблюдение после лечения
После завершения основного курса лечения (хирургического или лучевого) мониторинг состояния пациента продолжается в течение многих лет. Это необходимо для своевременного выявления возможного рецидива и контроля побочных эффектов.
Контроль уровня ПСА. Анализ крови на ПСА является основным инструментом наблюдения:
- После радикальной простатэктомии: Уровень ПСА должен упасть до неопределяемого значения (обычно менее 0,1 нг/мл) в течение нескольких недель. Любой стабильный рост уровня ПСА после операции может свидетельствовать о возвращении болезни.
- После лучевой терапии: Уровень ПСА снижается постепенно и может достичь своего минимума (надира) только через 1–2 года. Рост ПСА на 2 нг/мл выше достигнутого минимума считается признаком биохимического рецидива.
График обследований. Обычно анализы на ПСА проводятся каждые 6 месяцев в течение первых 5 лет, а затем ежегодно. Ректальное исследование может проводиться реже, особенно если простата была удалена.
Реабилитация и качество жизни
Особое внимание уделяется коррекции побочных эффектов:
- Проблемы с мочеиспусканием: При недержании мочи могут быть рекомендованы упражнения Кегеля для укрепления мышц тазового дна, медикаментозная терапия или, в сложных случаях, установка искусственного сфинктера.
- Сексуальное здоровье: Если развилась эректильная дисфункция, рассматриваются варианты медикаментозной поддержки (ингибиторы ФДЭ‑5), вакуумных устройств или инъекционной терапии. Своевременное начало реабилитации («пенильная реабилитация») повышает шансы на восстановление функции.
- Психологическая поддержка: Диагноз и последствия лечения могут вызывать стресс и депрессию. Рекомендуется посещение групп поддержки или консультации с онкопсихологом.
Питание и образ жизни после лечения
Хотя специфической диеты «от рака» не существует, соблюдение общих принципов здорового образа жизни помогает снизить риск рецидива и улучшить общее самочувствие:
- Поддержание индекса массы тела в пределах нормы.
- Ежедневная физическая активность (не менее 30 минут).
- Рацион с преобладанием растительной пищи и ограничением переработанного мяса.
